10 Soal & Pembahasan Teori Kinetik Gas (bagian 2) ǀ Pilihan Ganda
Kita
telah membahas 10 soal teori kinetik gas (bagian 1). Berikut 10 soal dan
pembahasan teori kinetik gas (bagian 2) yang dapat dipelajari sebelum ujian.
Baca
sebelumnya : 10 Soal & Pembahasan Teori Kinetik Gas (bagian 1) ǀ
Pilihan Ganda
Pilihlah
jawaban yang tepat dari pilihan di bawah ini.
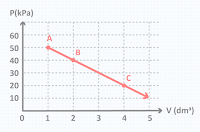
11. Perhatikan grafik P-V berikut ini!
Urutan suhu gas pada keadaan A, B, dan C dari yang terbesar hingga terkecil adalah . . .
A. TA>TB=TC
B. TC=TB>TA
C. TA=TB=TC
D. TA>TC>TB
E. TA>TB>TC
Pembahasan
:
Diketahui
:
*Kondisi
1
P1
= 50 ; P2 = 40 ; P3 = 20
V1
= 1 ; V2 = 2 ; V3 = 4
Ditanya
: Suhu T1, T2, dan T3
|
P1.V1/T1 |
= |
P2.V2/T2 |
= |
P3.V3/T3 |
|
50.1/T1 |
= |
40.2/T2 |
= |
20.4/T3 |
|
50/T1 |
= |
80/T2 |
= |
80/T3 |
Kita
tahu bahwa nilai T2 = T3, dan T1 adalah
50/T1
= 80/T2
T1
= (5/8)T2
Jadi,
nilai T1<T2=T3 atau TA<TB=TC
Jawaban
B.
12.
Balon yang awalnya berisi gas 0,75 liter ditambahkan gas yang sama sehingga
volumenya menjadi 1 liter. Massa gas di dalam balon berubah menjadi 3/2 kali
semula. Jika suhu balon tetap, maka rasio antara perubahan tekanan dan tekanan
awal adalah . . .
A. 2/3
B. 3/5
C. 1/8
D. 3/8
E. 5/8
Pembahasan
:
Diketahui
:
T =
konstan
V1
= 0,75 dm3
V2
= 1,00 dm3
m1
= m
m2
= 1,5 m
Ditanya
: Perbandingan perubahan tekanan dan tekanan kondisi 1 (ΔP/P)
*Mencari
perbandingan P1/P2 terlebih dahulu. Kita tidak perlu konversi satuan dm3 ke m3
karena keduanya sama-sama diketahui dan dapat dicoret.
|
P.V |
= |
nRT |
|
P.V |
= |
(m/M)RT |
|
PV |
= |
m |
Coret
besaran yang konstan pada sua kondisi ini, yaitu massa satu mol (M), suhu (T),
dan konstanta gas (R).
*Persamaan
menjadi
|
P.V |
= |
m |
|
(P1.V1)/(P2.V2) |
= |
m1/m2 |
|
(P1.0,75)/(P2.1) |
= |
m/1,5m |
|
P1/P2 |
= |
8/9 |
Jadi,
perbandingan ΔP = P2-P1 =
1, dan P1 = 8.
Jawaban
C.
13.
Balon awalnya berada pada suhu ruang. Jika balon dimasukkan ke dalam freezer,
maka yang terjadi pada balon tersebut adalah . .
A. Tekanan dan volume gas dalam balon meningkat
B. Tekanan gas dalam balon meningkat dan volumenya menurun
C. Tekanan gas dalam balon menurun dan volumenya meningkat
D. Tekanan dan volume gas dalam balon menurun
E. Tekanan dan volume gas dalam balon tidak berubah
Pembahasan
:
PV
= T
Saat
T turun, P dan V turun karena berbanding lurus. Hal ini terjadi karena ketiga
besaran tidak konstan. Satu-satunya yang konstan adalah jumlah partikel dalam
balon.
Jawaban
D.
Pertanyaan
berikut untuk menjawab soal nomor 14 dan 15
Ban
mobil diisi udara pada suhunya 10 oC dan tekanan atmosfer normal.
Selama proses tersebut, udara bertambah 25% dari volume awalnya dan suhunya
menjadi 40 oC.
14.
Tekanan ban sekarang . . .
A. 0,69 atm
B. 0,70 atm
C. 0,78
atm
D. 0,89 atm
E. 0,92 atm
Pembahasan
:
Diketahui
:
T1
= 10 oC = (10+273) = 283 K
T2
= 40 oC = (40+273) = 313 K
V1
= V
V2
= 1,25V
P1
= 1 atm (tidak perlu dirubah ke Pa)
Ditanya
: Tekanan kondisi 2 (P2)
|
P1V1/T1 |
= |
P2V2/T2 |
|
1.V/283 |
= |
P2 (1,25V)/313 |
|
P2 |
= |
0,89 |
Jawaban
D.
15.
Setelah mobil dikemudikan pada kecepatan tinggi, suhu udara dalam ban meningkat
kembali menjadi 85 oC. Jika volume dalam ban juga meningkat lagi 5%,
maka tekanan ban yang baru adalah . . .
A. 0,79
atm
B. 0,82 atm
C. 0,89
atm
D. 0,99 atm
E. 1,00 atm
Pembahasan
:
Diketahui
:
T1
= 10 oC = (10+273) = 283 K
T2
= 85 oC = (85+273) = 385 K
V1
= V
V2
= 1,30V
P1
= 1 atm (tidak perlu dirubah ke Pa)
Ditanya
: Tekanan kondisi 2 (P2)
|
P1V1/T1 |
= |
P2V2/T2 |
|
1.V/283 |
= |
P2 (1,30V)/385 |
|
P2 |
= |
0,89 |
Jawaban C.
16. Perhatikan
gambar berikut!
Tiga silinder piston identik yang tidak di ketahui jumlah partikelnya mengalami proses yang menyebabkan keadaan akhir ketiga sistem seperti pada gambar. Gambar di atas menunjukkan keadaan piston pada saat suhu di setiap silinder T, 2T, dan 3T. Jika gaya gesek diabaikan, maka perbandingan jumlah partikel pada silinder A : B : C adalah . . .
A.
1 : 2 : 3
B.
3 : 2 : 1
C. 1 : 1 : 1
D. 2 : 3 : 4
E. 4 : 3 : 2
Pembahasan
:
Jumlah
partikel dan volume dari ketiga silinder sama. Suhu yang berbeda mengakibatkan
tekanan ketiganya berbeda. Suhu tertinggi dalam kondisi ini memiliki tekanan
paling tinggi.
Jawaban
C.
17.
Perhatikan gambar berikut!
A. Partikel semakin sering menumbuk dinding
B.
Partikel semakin jarang menumbuk dinding
C. Energi kinetik rata-rata partikel gas bertambah besar
D. Energi kinetik rata-rata partikel gas berkurang
E. Partikel bergerak dengan kelajuan yang semakin besar
Pembahasan
:
Saat
suhu tetap dan volume dikompresi, tekanan akan semakin tinggi. Akibatnya
partikel akan lebih sering menumbuk dinding.
Jawaban
A.
18.
Gas monoatomik bergerak secara translasi ke arah sumbu X, Y, dan Z. Oleh karena
itu, derajat kebebasannya sebesar . . .
A. 1
B. 3/2
C. 5/2
D. 3
E. 5
Pembahasan
:
Saat
gerak gas hanya translasi, suhu yang dimiliki gas pasti kurang lebih 300 K.
Derajat kebebasannya adalah 3/2
Jawaban
B.
19.
Dua mol sampel gas oksigen berada dalam tangki 5 L dan tekanan 1 atm. Energi
kinetik rata-rata partikel gas tersebut adalah . . .
A. 5,2 x 10-21 J
B. 5,6 x 10-21 J
C. 6,2 x 10-21 J
D. 7,1
x 10-21 J
E. 8,6 x 10-21 J
Pembahasan
:
Diketahui :
n = 2 mol
V1 = 5 dm3 =
5 x 10-3 m3
P1 = 105 Pa
k = 1,38 x 10-23 J/K
R = 8,315 J/mol.K
Ditanya : Energi kinetik rata-rata
(Ek)
Ek = 3.P.V/2N
Ek = 3.P.V/(2.nR/k)
Ek = 3.P.V.k/(2.nR)
Ek = 3.105.(5 x 10-3)(1,38
x 10-23)/(2.2.(8,315))
Ek = 20,7 x 10-21/33,26
Ek = 0,622 x 10-21 J
Jawaban
C.
20. Perhatikan grafik P-V berikut!
Energi kinetik rata-rata pada proses A ke B (EkA dan EkB) adalah . . .
A. EkA = (1/5) EkB
B. EkA = EkB
C. EkA = (5/2) EkB
D. EkA
= 3 EkB
E. EkA = 5 EkB
Pembahasan
:
Diketahui :
Ek = 3.P.V/2N
N = 3.P.V/2.Ek
P = konstan
NA = NB
VA = V
VB = 5V
Ditanya : Nilai energi kinetik
rata-rata kondisi A (EkA)
|
NA |
= |
NB |
|
3.PA.VA/2.EkA |
= |
3.PB.VB/2.EkB |
|
P.VA/EkA |
= |
P.VB/EkB |
|
VA/EkA |
= |
VB/EkB |
|
V/EkA |
= |
5V/EkB |
|
EkA |
= |
(1/5) EkB |
Jawaban
A.
Baca
selanjutnya : 10 Soal & Pembahasan Teori Kinetik Gas (bagian 3) ǀ
Pilihan Ganda
Itulah
10 soal dan pembahasan teori kinetik gas yang mencakup beberapa sub bab. Klik
untuk melanjutkan pembahasan